Coronavirus: por qué los anticuerpos se desvanecen después de una infección de covid-19 (¿y puede pasar lo mismo con las vacunas?)
- Steven Smith
- *The Conversation
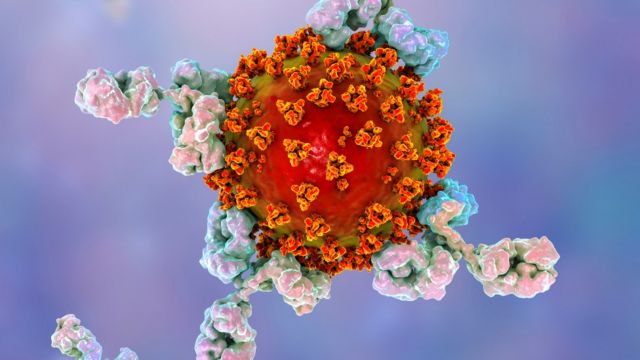
Los niveles de anticuerpos que protegen a una persona después de la infección de coronavirus disminuyen "con bastante rapidez", según estudios. La ilustración muestra anticuerpos atacando al virus de la covid-19.
El objetivo de las vacunas para la covid-19 que se están administrando en todo el mundo es estimular nuestro sistema inmunológico para que produzca una respuesta protectora contra el coronavirus, particularmente mediante la generación de anticuerpos.
Estos anticuerpos circulan luego en nuestra sangre hasta que sean necesarios para atacar y eliminar el coronavirus rápidamente de nuestros organismos si nos infectamos.
La velocidad con la que las comunidades científica y médica desarrollaron y probaron estas nuevas vacunas ha sido extraordinaria.
Sin embargo, debido a esa rapidez hay preguntas aún pendientes.
Uno de esos interrogantes clave es cuánto tiempo durará la protección que recibimos de la vacuna o incluso de la infección por el virus mismo.
Final de Quizás también te interese
Ya sabemos, por ejemplo, que los niveles de anticuerpos caen con bastante rapidez después de una infección de covid-19.
Cómo recuerda el sistema inmunológico
La notable capacidad de nuestro organismo para recordar encuentros pasados con microorganismos infecciosos y retener defensas sólidas contra ellos se debe al fenómeno de la memoria inmunológica.
Esta memoria reside en los glóbulos blancos conocidos como linfocitos, de los cuales hay dos tipos principales: células T y células B.
Cuando el cuerpo se enfrenta a un nuevo desafío, ya sea una nueva infección o una vacuna, se reclutan células T y células B específicas para enfrentarlo.
El cuerpo mantiene versiones "memoria" de estas células por si vuelve a encontrar al mismo microorganismo en el futuro.
Son estas células B las responsables de la liberación de anticuerpos a la sangre.
Cuando ocurre una infección o cuando nos vacunan, algunos de esos anticuerpos se metamorfosean en fábricas especializadas de producción de anticuerpos, conocidas como células plasmáticas.
Los anticuerpos son proteínas y, como cualquier otra proteína, se descompondrán y eliminarán naturalmente del cuerpo en unos pocos meses como máximo.
Esta es la razón por la que la protección de los anticuerpos que recibimos pasivamente, por ejemplo, de nuestras madres en el útero o a través de la leche materna no dura mucho.
Para una protección a más largo plazo necesitamos producir anticuerpos generados por nosotros mismos.
Las características de las vacunas también determinan la naturaleza de la respuesta a nivel de los anticuerpos.
La capacidad de nuestro organismo para mantener los niveles de anticuerpos después de una infección o vacunación es el resultado de dos mecanismos. En las primeras etapas, si las células B de memoria detectan alguna infección persistente o una vacuna, algunas continuarán transformándose en nuevas células plasmáticas productoras de anticuerpos.
Una vez que la infección o la vacuna se ha eliminado por completo, las células B de memoria ya no reponen la población de células plasmáticas, que disminuye.
Sin embargo, algunas pueden persistir como células plasmáticas de larga vida (LLPC, por sus siglas en inglés), que pueden vivir durante muchos años en nuestra médula ósea, fabricando y liberando continuamente grandes cantidades de anticuerpos.
Las LLPC no siempre son generadas después de una infección, pero si lo son, se pueden encontrar anticuerpos contra una infección específica en la sangre durante mucho tiempo después de que la infección haya desaparecido.
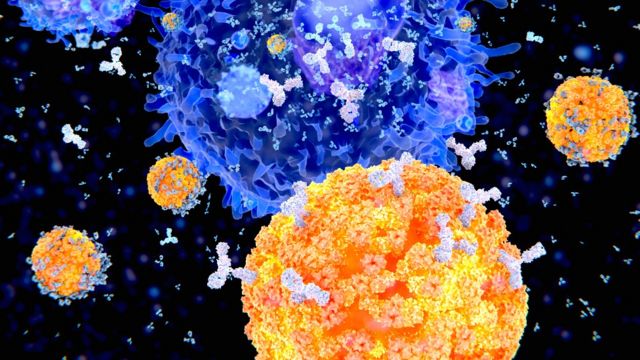
En esta ilustración se ven células plasma (células B, en naranja) produciendo anticuerpos (en blanco) para combatir un virus (en azul).
Aunque todavía no comprendemos completamente qué condiciones de inmunización son las mejores para generar LLPC, la presencia de estas células se ha vinculado con ciertos sitios en el cuerpo.
Por ejemplo, un grupo de investigadores en Estados Unidos se descubrió que las LLPC parecen preferir la médula de ciertos huesos a otros.
Diez años después de la vacunación contra el tétanos, las LLPC se encontraron en la médula ósea del fémur, el húmero y la tibia con mucha más frecuencia que en las costillas, el radio, las vértebras o la cresta ilíaca.
Aún no está claro por qué las LLPC prefieren la médula de estos huesos. Una posibilidad interesante es que la respuesta esté en las diferencias en el nivel de grasa de la médula ósea.
Se descubrió que las LLPC están rodeadas de una gran cantidad de células grasas o adiposas en los huesos que prefieren.
Esto sugiere que puede ser el contenido de grasa de la médula ósea lo que afecta la capacidad de las LLPC para moverse hacia ciertos huesos y residir a largo plazo en ellos.
Pero aún si no se crean LLPC, eso no significa que alguien no pueda generar más anticuerpos contra una amenaza si vuelve a encontrarla en el futuro.
Siempre que la persona haya generado células B de memoria, estas reconocerán la amenaza y, una vez más, algunas comenzarán a transformarse en nuevas células plasmáticas para comenzar la producción de anticuerpos una vez más.
El tipo de vacuna también afecta la durabilidad
Hay muchas razones por las que la vacunación o la infección no siempre brindan una protección duradera.
Esto se debe en parte a la variación individual en nuestra respuesta a una vacuna determinada.
Sin embargo, las características de las vacunas también determinan la naturaleza de la respuesta a nivel de los anticuerpos.
Un estudio encontró que, aunque una mayor proporción de personas que recibieron vacunas contra el tétanos y la difteria desarrollaron anticuerpos protectores, estos anticuerpos desaparecieron más rápidamente que los generados por las vacunas contra el sarampión, las paperas o la viruela.
Los anticuerpos generados por las vacunas contra el tétanos y la difteria desaparecieron más rápidamente que los generados por las vacunas contra el sarampión, las paperas o la viruela, según un estudio.
La diferencia clave entre estas inoculaciones es que las vacunas contra el tétanos y la difteria contienen solo proteínas aisladas (versiones modificadas de las toxinas que producen las bacterias del tétanos y la difteria), mientras que las vacunas contra el sarampión, las paperas y la viruela contienen versiones vivas y debilitadas de estos virus.
Es posible que algunas personas no produzcan buenas respuestas a las vacunas vivas debido a la inmunidad preexistente a la vacuna en sí, generada porque ya han tenido una infección natural.
Sin embargo, aquellos que responden bien tienden a mantener sus respuestas por más tiempo. Esto se debe en parte a la persistencia de la vacuna viva en el cuerpo, lo que estimula la reposición a corto plazo de las células plasmáticas.
También es probable que las vacunas vivas sean mejores para producir LLPC.
Ya hemos visto que la velocidad a la que los anticuerpos se descomponen después de una infección de covid-19 puede diferir, por ejemplo, entre hombres y mujeres.
Muchas de las nuevas vacunas para la covid-19 se basan en métodos de administración novedosos, como vectores virales o moléculas de ARN mensajero.
Claramente, estos mecanismos son muy efectivos para brindar una protección rápida.
Pero aún queda por verse qué tan bien activarán las células B de memoria y las LLPC para impartir inmunidad de larga duración.
*Este artículo se publicó originalmente en The Conversation. Puedes leer la versión original aquí.
Steven Smith es profesor de Ciencias Biomédicas de la Universidad Brunel en Londres.



No hay comentarios:
Publicar un comentario