A la caza de la huella oculta del alzhéimer incipiente
https://elpais.com/elpais/2018/04/11/ciencia/1523455502_839059.html
Investigadores de Madrid y Japón combinan el estudio de marcadores bioquímicos con neuroimágenes
Barcelona
La enfermedad de Alzheimer le llevaba 20 años de ventaja a la investigación médica. Ese es el tiempo que suele transcurrir desde que se empieza a desarrollar la dolencia neurodegenerativa hasta que se manifiestan los primeros síntomas perceptibles, como la pérdida de memoria o la desorientación. Cuando los neurólogos detectan el alzhéimer, ya han pasado casi dos décadas desde que empezó realmente el deterioro cerebral y poco o nada hay que hacer: la enfermedad ya se encuentra en un estadio avanzado, irreversible, y lo único para combatirla son los fármacos sintomáticos para mejorar ligeramente el estado del paciente. En los últimos años, no obstante, la comunidad científica ha pisado el acelerador y empieza a acercar posiciones con la escurridiza dolencia. Los investigadores buscan, a contrarreloj, marcas y señales cerebrales que indiquen el inicio del deterioro cognitivo, antes incluso de que provoque síntomas clínicos. La meta: abordar y frenar la enfermedad en el estadio más incipiente.
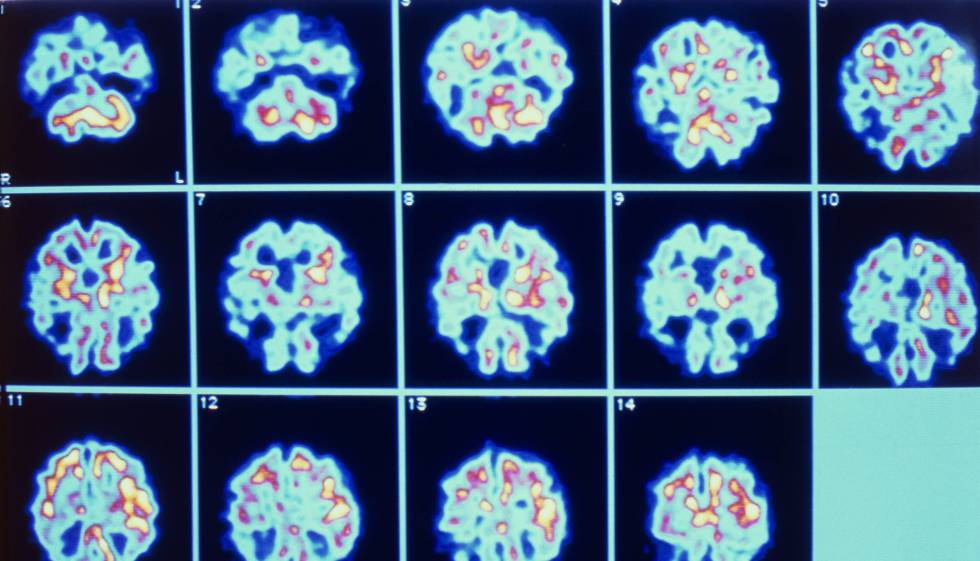
Las primeras alteraciones producidas por el alzhéimer se dan a nivel bioquímico en el tejido cerebral. Se trata de la acumulación de placas de proteína beta-amiloide (AB) en el exterior de las neuronas y la formación intracelular de ovillos neurofibrilares de proteína TAU, los dos marcadores que se muestran en las fases más tempranas de la enfermedad. La presencia de placas de amiloide, que se detectan a través de técnicas bastante invasivas como la punción lumbar o el dispositivo de neuroimagen PET (tomografía por emisión de positrones), mide el riesgo de enfermedad de alzhéimer; el acúmulo de hilillos de TAU, que también se determina vía punción lumbar o PET, es un marcador de daño cerebral vinculado a la muerte de las neuronas. El problema es que la acumulación de estas proteínas no es totalmente determinante para desarrollar alzhéimer, pues también se encuentran en otras demencias relacionadas con el envejecimiento.
De ahí que el siguiente paso de los investigadores haya sido combinar las huellas bioquímicas que deja la enfermedad con otros marcadores de neuroimagen (como la volumetría, medida con una resonancia magnética) para afinar el diagnóstico precoz del alzhéimer. En este sentido, investigadores de las universidades Complutense y Politécnica de Madrid han participado en un estudio con el National Centre for Geriatrics and Gerontology de Japón para detectar los primeros signos del alzhéimer con marcadores mínimamente invasivos. El estudio, publicado en la revista científica Brain, encontró alteraciones en los patrones de actividad cerebral relacionadas con la cantidad de placas de amiloide acumuladas en el cerebro.
“Hay muchas enfermedades enmascaradas que tienen los mismos síntomas que en el alzhéimer. Nosotros hemos analizado la actividad cerebral de ancianos sanos y con deterioro cognitivo leve a través de la magnetoencefalografía (MEG), una técnica que detecta los campos magnéticos generados por la actividad eléctrica de las neuronas”, explica Pablo Cuesta, uno de los firmantes del estudio. Los investigadores combinaron el análisis de los patrones oscilatorios de la actividad cerebral en reposo —en esta situación la mayor parte de la energía que emana del cerebro tiene una frecuencia de 10 hercios (Hz), 10 ondas por segundo, sobre los que oscila la actividad cerebral— con la información recogida en los PET de amiloide y de glucosa (para medir el metabolismo neuronal), y la resonancia magnética (estima el daño del tejido cerebral).
El estudio encuentra alteraciones en los patrones de actividad cerebral relacionadas con la cantidad de placas de amiloide acumuladas en el cerebro
“Los análisis de la actividad cerebral registrada con magnetoeencefalografía mostraron alteraciones asociadas al grado de acumulación de proteína beta amiloide, al estadio de la enfermedad y al nivel de deterioro cognitivo”, señala Cuesta. Los científicos ya sabían que el alzhéimer, al igual que el envejecimiento, enlentece el patrón de oscilación: el cerebro emite más energía a frecuencias bajas y menos a frecuencias cercanas a 10hz. Este efecto, sin embargo, está vinculado al deterioro cognitivo, pero no es determinante para diagnosticar un alzhéimer incipiente. Por eso los investigadores se valieron de la combinación de otros biomarcadores vinculados a esta enfermedad y descubrieron unos cambios en la actividad cerebral asociados a las personas que presentan placas de amiloide en el cerebro. “Los pacientes con inicio de acumulación de amiloide mostraban un incremento de la actividad oscilatoria a 10 hz en la región frontal del cerebro respecto a los sujetos sin acumulación de amiloide”, señala Cuesta. Este marcador no solo aparecía en personas con placas amiloide y deterioro cognitivo leve, sino también en sujetos que, pese a tener acumulación de amiloide en el cerebro, aún no había desarrollado ningún tipo de deterioro cognitivo, estructural o metabólico patente.
Cuesta sostiene que los investigadores harán un seguimiento de los ancianos estudiados para perfeccionar estos nuevos biomarcadores. El análisis de la MEG, señala el investigador, “abre una vía a diagnosticar precozmente el alzhéimer con una técnicamente poco invasiva”.
Sin alternativa terapéutica
Esta vuelta de tuerca en la investigación del alzhéimer a favor de la detección temprana de la enfermedad ha dejado, sin embargo, un elemento en el aire: el tratamiento. “En los últimos 10 años ha habido una revolución en el diagnóstico del alzhéimer, pero se ha avanzado poco en el tratamiento. Es frustrante para el paciente y para el médico porque lo detectas antes pero no tienes nada que darles para pararlo”, explica el doctor David Pérez, portavoz del grupo de estudio de Conductas y Demencias de la Sociedad Española de Neurología.
Solo hay tratamientos sintomáticos y los resultados son pobres. “Mejoran los síntomas levemente, pero cuando el paciente ya está en la fase de demencia”, agrega. La comunidad científica investiga moléculas para retirar las proteínas amiloide y TAU, pero todavía no hay resultados fructíferos. “Estamos en una etapa de reconsideración de qué está pasando. No sabemos el origen del alzhéimer, qué hay detrás de esa proteínopatía. Hay algo oculto que aún no sabemos”, admite Pérez.
CAMBIOS CEREBRALES EN PERSONAS SANAS CON RIESGO GENÉTICO
En este afán por “adelantarse a la enfermedad”, otros investigadores de la Fundación Pasqual Maragall de Barcelona también han optado también por combinar diversos mecanismos de detección para calibrar la probabilidad de alzhéimer en un tipo de personas muy concreto: las que tienen un riesgo genético de desarrollar la enfermedad. En términos cuantitativos, el alzhéimer hereditario apenas alcanza el 1% de los casos, pero los investigadores saben que hay un gen —el APOE-E4— que confiere al portador un elevado riesgo de sufrir la enfermedad. El centro catalán, que dispone de la cohorte más grande de personas sanas portadoras del APOE-E4, ha probado que los sujetos con dos alelos E4 (del padre y de la madre) del gen APOE tienen diferencias morfológicas en la zona del cerebro donde se inicia la neurodegeneración del alzhéimer.
El gen APOE lo tiene todo el mundo, pero se puede presentar de forma distinta por la combinación de los alelos E2, E3, y E4. El APOE con dos alelos de E4 confiere el mayor riesgo de alzhéimer. Los investigadores, que publicaron el estudio enAlxheimer & Dementia, analizaron la resonancia magnética de 533 participantes dela cohorte Alfa (formada por familiares sanos de pacientes con alzhéimer) y descubrieron que a mayor número de alelos E4, menor volumen de sustancia gris hay en el hipocampo, una de las zonas del cerebro vinculadas a la neurodegeneración. Cuantos más E4, también se detectó un aumento de la sustancia gris en otras zonas del cerebro (tálamo, lóbulo occipital y córtex derecho frontal) que podría estar relacionadas con un mecanismo inflamatorio por la acumulación de las placas amiloide.
“Lo que encontramos son áreas que tienen más o menos volumen de lo esperado. Hay cambios que tienen que ver con el gen, que siempre han estado ahí; otros cambios están asociados a la presencia de características moleculares como la proteína amiloide; y hay otros cambios que se dan en áreas del hipocampo relacionadas a una incipiente neurodegeneración”, sostiene Juan Domingo Gispert, jefe del grupo de investigación en neuroimagen de la Pasqual Maragall.

No hay comentarios:
Publicar un comentario